【まだ動かない?】新薬を巡る知財保護制度の進展
中国の「新薬の知財保護」の新制度のグランドデザインは、2017年に国務院の公表による「新薬等の研究開発を推進する為の承認申請制度の改革に関する政策文書(42号文書)(关于深化审评审批制度改革鼓励药品医疗器械创新的意见)」の中で、下記の3つの制度を導入する旨、明記されています。
- 特許期間の延長
- データ保護
- Patent linkage制度
その後、2021年1月、トランプの“活躍”で「米中貿易協議書」の中に中国の知財保護制度の改正に対して言及されており、中国は、新薬等の知財保護として、上記の①、➁、③の3制度の導入をアメリカに対してコミットしました。
そして、2021年6月に改正特許法が施行され、その中には、上記の①、③が条文として盛り込まれました。さて、現在、具体的な実施状況は如何に?
1.Patent Linkage
先発の新薬をカバーする特許(一般に当該新薬を開発した企業が所有する特許:「新薬特許」)の満了前に、対応のジェネリック薬が薬事当局(NMPA)に販売承認申請された場合、NMPAは、当該ジェネリック薬の医薬品としての有効性・安全性等の必要要件を満たしているか否かの審査以外に、ジェネリック薬が「新薬特許」を侵害しているか否かについて、裁判所・特許庁に判断させます。このように薬事の承認審査の過程で特許問題もリンクさせて、もし、侵害であれば、NMPAは当該ジェネリック薬の承認を付与しない、という制度がPatent Linkageです。したがって、「新薬特許」が有効期間中は、“原則として”、ジェネリック薬は承認されない、よって、上市されなくなる、ということを意味しています。
上記の通り、2021年6月の改正特許法に対応条文が盛り込まれ、その後、関係官庁(特許庁、MNPA、裁判所)から手続き細則が公表されています(参照:https://www.kawamotobbp.jp/articles/1470)。そして、先の4月(2023年)に最高裁判所より、2022年の代表判決の一つとして、patent linkage制度の下での判決が挙げられました。それは、中外製薬が中国で上市している製品に関連するソフトカプセルについての製剤特許に基づく係争でした。対応のジェネリック薬が申請されたことに対して、中外がpatent linkage制度の下で、ジェネリック企業に対して当該製剤特許の侵害を主張し、訴えた案件でした。結果は、ジェネリック薬は中外の製剤特許の権利範囲に入らないので、侵害しないというものでした。また、それ以外も含めて、Patent Linkage制度の下、2022年一年間に7件の判決が出でおり、第二審(最高裁判所)の審理期間は平均63日であったとしています。
このようにPatent Linkage制度は、動き出しており、新制度の運用事例が積み重ねられている段階と言えます。
2.特許期間の延長
新薬は上市の承認に至るまでの研究開発の期間が長いことから上市した際に残存している特許期間が短くなっている実態を踏まえて、5年間を上限として、特許期間を延長する制度です。延長された場合、特許期間は、最長、出願から25年となります。
2021年の改正特許法に連動して、2020年末にその実施細則の草案が公表され、2021年には審査便覧(審査指南書)改正案の公表と続きました。これらの草案の中で、特許期間の延長期間の計算方法も含め、詳細な規定案が示されていましたが、この時点では未だ、最終化されていません。
どうなっているのでしょうか?
下記グラフをご覧ください。IND申請(治験申請)、NDA(上市承認申請)の過去5年の推移です。過去、8年に遡りますと、右肩上がりの傾向が浮き上がるのですが、昨年22年はコロナ禍の影響もあってNDA件数自体は、減っています。
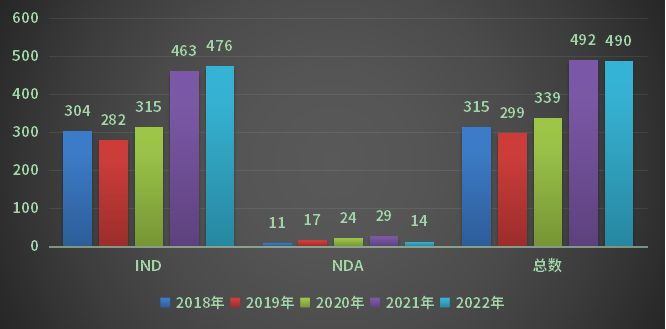
INDとNDAの件数の総計は490件となりますが、海外からの申請(輸入申請)と国内製造を前提とした申請の内訳は、下記の通りとなります。国内製造を前提にした申請が輸入の3.3倍となっています。
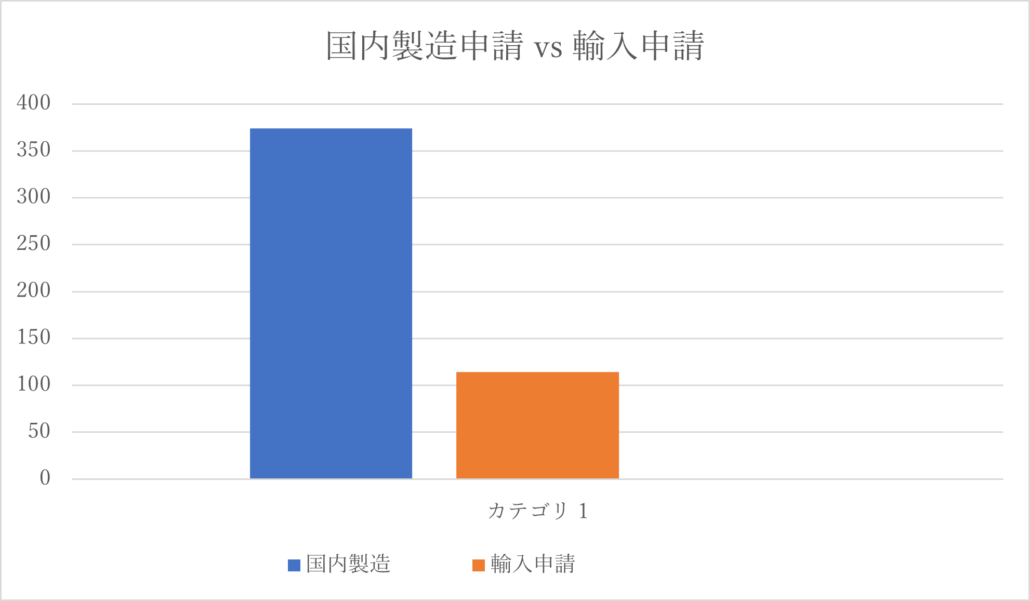
国内製造を前提とした申請の件数が増えており、その多くは中国の内資企業による申請です。特に内資企業によるIND申請が激増しています。そして、2022年に24件に販売承認が下りていますが、このうち、70%が中国の内資企業によるものです。
従来は、中国の新薬の知財保護制度は、外資の利権を守る為、特に、米国からの圧力によって制度の整備がされてきた経緯があります。しかしながら、ここにきて、新薬の申請件数等、明確に、中国の内資企業が多くを占めるに至っています。いまだ、中国ではジェネリックビジネスの利権が強いとされていますが、新薬の国内企業の利権も無視できないレベルにまで上がってきているのも事実です。
新内閣(国務院)が3月に発足し、新体制が動き出して、3か月が経過。経済活性化の為に、新内閣が知財制度も含めて、イノベーションを推進する具体策を打ち出すと期待されています。
そういった中国の国内の経済環境下、特許期間に関する実施細則について、暫定措置も含めて、遠からずの内に、何らかの具体的な規則が出てくるものと思われます。
3.データ保護
新薬の承認をNMPAが付与するにあたって、「新薬特許」の有無に関わらず、一定期間(5~6年)、NMPAはジェネリック薬の承認を付与しないという制度です。ジェネリック薬は申請にあたって、先発の新薬の承認の対象となったデータを引用することを前提に簡略試験(先発との同等性等に関する非臨床、臨床)の実施による申請が認められますが、「データ保護」とは、先発の当該データを保護して、ジェネリックの引用を認めないという概念から来ています。「データ保護」は薬事法の下での処理となってきました、即ち、NMPAが推進母体です。2022年5月に薬事法の「実施条例」案が公表され、その中で、「データ保護」の関連条文が盛り込まれています(参照https://www.kawamotobbp.jp/articles/1904)。しかしながら、その後、目に見えた進展はありません。
「特許期間の延長」は、上記の通り、制度の早期導入に対して、中国内資からの圧力は高まっているのですが、「データ保護」については、その次、という位置づけとなっています。内資というよりも、外資の利権を注視した制度とも言えるからです。すなわち、日本も含め、企業によっては、欧米での開発を先行し、そこでの上市後に中国で初めて開発に着手するというグローバルの開発設計により、中国で新薬を上市する際には、場合によっては、特許期間が切れているということもありえます。その意味で、外資にとって、特に中国開発に後れを取っている日本企業にとっては、特許の有無に関わらず、「データ保護」によってジェネリックの上市を阻止して、独占権を確保するという意味で、早期導入が必要な情勢です。また、外資から新薬のライセンス導入を企てている中国の内資企業にとっても「データ保護」は欲しい制度となっています。しかしながら、昨今の米中摩擦により、外資の利権を代表するアメリカの圧力が強く効かなくなっている情勢下、米中摩擦の緩和待ち、といった情勢とも言えると思います。
4.まとめ
李強(総理)が率いる新政権の下での「特許期間の延長」について、具体的な細則の施行がそう遠からずのうちに実現されるであろうということ。「データ保護」については、国際情勢の影響を受け、ポジティブな意味で大きな変動がなければ、少し、先の話にもなりうる情勢読みです。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 政策行政2026年2月13日中国の新薬データ保護・希少薬等の販売独占制度「医薬品管理法実施条例」公布
政策行政2026年2月13日中国の新薬データ保護・希少薬等の販売独占制度「医薬品管理法実施条例」公布 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年



返信を残す
Want to join the discussion?Feel free to contribute!