米欧+中国での新薬承認 コロナ禍の2022年上半期の実績
米国、欧州、中国の上市承認の件数と中国の躍進
コロナ禍にあって、2022年上半期はコロナワクチン、コロナ治療薬の開発および上市承認が進展をみましたが、他の疾患領域での上市承認も歩みを止めることはありませんでした。米国、欧州、中国の三極の薬事当局(FDA, EMA, NMPA)がこの期間中に上市承認を付与した新薬の疾患領域別の件数は、癌(肿瘤)がトップ、その次は感染症でした。癌領域では、三極の内、中国(NMPA)の上市承認の件数がトップ(下記グラフの黒色)となっています。下記のとおりです。
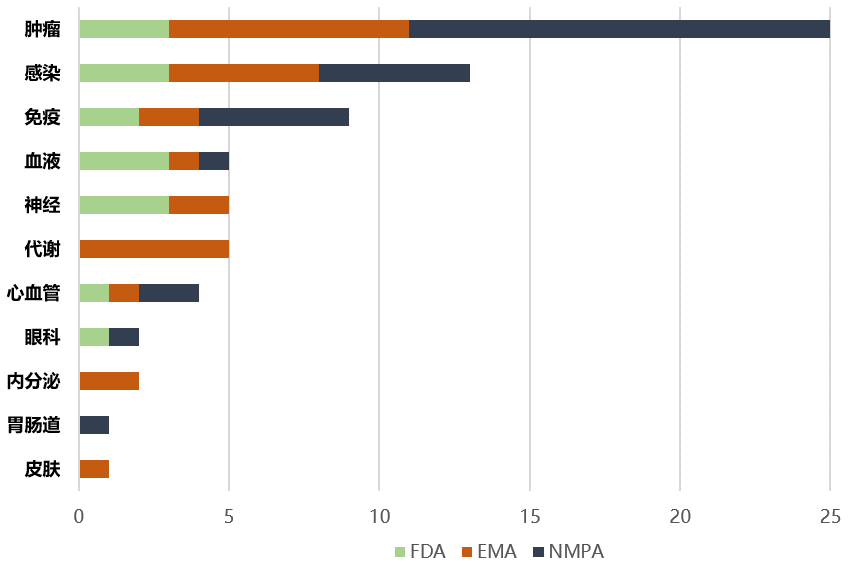
なお2022年上半期、新薬に対して世界で最初に上市承認を付与した薬事当局としては、FDAが14剤の新薬を承認しトップ。EMA(欧州)が5剤、NMPA(中国)は、自主研究開発の進展により7剤となっています。承認対象は、低分子化合物以外に抗体、細胞治療等が含まれています。
中国企業の中国での新薬承認リスト(2022年上半期)
NMPA(中国)が世界で最初に承認を付与した新薬は下記のリストの通りです(一部例外あり)。
| 承認日 | 登録分類等 | 適応症の概略 | 企業名 |
|---|---|---|---|
| 1/10 | 漢方1.2類 | 肝細胞癌 | Shenogen (珅诺基) |
| 1/26 | 抗体 1類 | 狂犬病 | North China Pharma (華北製薬) |
| 3/1 | 組換ワクチン | コロナ・ワクチン | Zhife Biological (智飛生物) |
| 4/13 | 低分子1類 | 逆流性食道炎 | Luoxin (罗欣薬業) ラクオリア創薬からのライセンス導入品 |
| 3/24 | PD1抗体 | 癌 | Henlius (复宏汉霖) |
| 6/29 | 二重特異性抗体 (PD1/CTLA-4) | 癌 | Akeso (康方生物) |
| 6/29 | AR阻害剤 1類 | 前立腺癌 | HengRui (恒瑞医薬) |
中国企業の新薬承認からみるR&D力
上記のリストの通り、漢方薬、狂犬病薬等は、中国の典型的なdomestic drugに該当します。また、アジアで開発が先行している薬剤も含まれています。ただ、中国企業はグローバル化を視点にR&Dを進めていますので、今後、中国企業の研究開発にかかる新薬が中国のNMPAでなく、FDAで先に上市承認されるケースも出てくると思われます。さて、我々日本企業はそのような新薬プロジェクトを先に掴みに行く(ライセンスを取得する)為のwatch体制を整備していく必要があります。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年 政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表
政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表





返信を残す
Want to join the discussion?Feel free to contribute!