6月に施行された特許延長制度、施行されなかったいくつかの細則
6月1日から改正特許法が施行されました。中国の医薬品業界に大きな影響を与える二つの制度が盛り込まれています。「特許期間の延長」、および「パテントリンケージ」です。今回は特許期間の延長について解説します。
なお、もう一つの柱である「データ保護制度」については、2018年に中国の薬事当局(NMPA)が「薬品試験データ保護の実施弁法(暫定)」「データ保護弁法(案)」を公表して以来、具体的な検討状況等が公表されていません。(詳細は「新薬データ保護期間の新法案と動向のまとめ」を参照ください)
1.延長制度改正の経緯・現状
2017年に国務院が「医薬品等の承認審査制度の改革及び医薬品等のイノベーション推進に関する政策文書」(42号文書)において特許期間の延長制度の導入を発表してから制度設計の議論が本格化しました。
中国の医薬品市場の9割以上はジェネリック品が占めているため、ジェネリックの市場参入を遅らせることに繋がる特許期間延長の政策は中国国内の旧勢力から大きな抵抗にあいました。一方で、中国では国を挙げてイノベーション推進、ジェネリックから新薬への転換の大きな流れができあがっている中で、中国のベンチャーも含めた内資の新薬の研究開発に巨額の資本が積極投入されており、新薬に対する特許期間延長の制度を推進する国内勢力も台頭してきています。
そういった中で、米国のトランプ政権時代である2020年1月「米中貿易協議書」が成立し、中国は特許延長制度を導入し、新薬の物質、用途、製造方法の発明に関する特許を延長の対象にする旨、アメリカに対してコミットしました(経緯については「特許法の第四次改正」でくわしく解説しています)。
その後、2020年10月に特許法の改正が成立(2021年6月1日に施行)、新薬の特許期間は5年を限度に(但し、新薬の上市後14年を越えない)延長されることが確定しました。
その延長制度の細則案については、2020年11月に公表された「特許法実施細則改正案《专利法实施细则修改建议》」の§85の4~8で公表されています。そして改正特許法が施行される6月1日までに上記の特許法実施細則が最終化され施行されることが期待されていましたが、結局調整つかずで、下記の暫定措置が発表されました。今の時点では、特許法実施細則は1か月~半年以内に最終化される予定です。
このように、特許法実施細則の最終化までの暫定措置について、特許局は5月24日に「改正特許法の施行に当たっての関連審査業務の暫定処理の弁法《关于施行修改后专利法的相关审查业务处理暂行办法》」を公表しました(6月1日施行。以下「暫定弁法」)を公表しました。その§6で、新薬の上市承認を取得した者は「3か月以内に特許局に特許期間の延長を申請すること」、「当該申請に対する審査は上記の特許法実施細則が施行されてから開始する」としています。
2.特許延長の細則案
上記の通り、特許期間の延長の細則についてはまだ最終稿が確定してない段階ですが、現状では前記の特許法実施細則の改正作業の中で、下記を中心に検討がされています。なお、下記の説明のうち、特許法の規定を引用している場合は確定している内容です。
1)延長対象の特許
・化学医薬品、バイオ医薬品、漢方薬であって、NMPAが新薬の上市承認を付与した新規活性成分に関連する「物質特許」、「製造法特許」、「用途特許」が延長の対象になります(特許法実施細則(案)§85-4)。
・特許実施細則が最終化の過程で、結晶型特許等の取り扱いが明確化されると想定しています。
2)延長期間の計算式
・延長期間=「新薬の上市承認日」ー「特許の申請日」ー「5年」(特許法実施細則(案)§85-5)
・ただし、延長期間は「5年」を越えず、かつ延長後の期間は新薬の上市承認日から「14年」を越えない(特許法§42)。
当初は、米国型の計算式が採用されると言われていましたが、それは特許法に盛り込まれた5年と14年のそれぞれの足切り制限のみで、計算式は欧州型のシンプルな計算式を採用しています。なお、特許法実施細則の最終化の過程で、上記の計算式に新たな条件の付加等の微調整がされる予定です。
3)延長される特許権の効力の範囲
・NMPAが上市を認めた新薬であって、承認の対象となった適応症の範囲に限定される(特許法実施細則(案)§85-6)。
4)延長される特許の数
・NMPAが上市を認めた新薬の対応特許が複数あったとしても、延長が認められるのは、「一件」の特許のみ。かつ、延長は「一回」のみ(特許法実施細則(案)§85-7)。
これは日本のように新薬承認に対して複数の特許を延長したり、追加の適応症の承認毎に何回でも延長したりできるわけではなく、欧米型で、一特許・一回のみです。なお、最初の適応症の新薬の上市承認に際して、ある特許、例えば物質特許が延長され、その延長された有効特許期間内に追加適応症の上市承認が得られた場合の取扱い等は、今後明らかにされる予定です。
・延長申請は、NMPAが新薬の上市承認をした日から3か月以内に特許局に対して行う必要があります(特許法実施細則(案)§85-7)。
5)延長申請の審査手続き、不服手続き
特許権者から延長請求があった場合は、特許局が審査して、拒絶の理由があれば却下決定。拒絶の理由がなければ、延長決定・登録・公告します。この決定に不服の場合、3か月以内に裁判所に訴えることができます(特許法実施細則(案)§85-8)。
3.2021年6月1日より以前に上市承認済みの新薬の取り扱い
改正特許法の施行日2021年6月1日以前に上市承認が付与されている新薬であって、それをカバーする特許が満了していない場合に、当該特許は期間延長の対象になるのか否かが議論を呼んでいました。その背景は下記の通りです。
1)外資の圧力
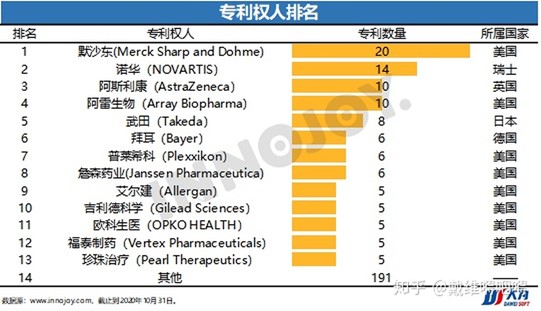
(1)2021年6月1日時点、中国で新薬をカバーする特許権者は下記の通り(アメリカのオレンジブック掲載の米国特許の中国対応特許をベース)とされています。新薬に関連する特許を5件以上所有している可能性がある企業14社の内、米国(美国)系が9社です。トランプが米中貿易協議のなかで、知財のアメリカ利権をあれだけ強調した背景が浮かび上がってきます。
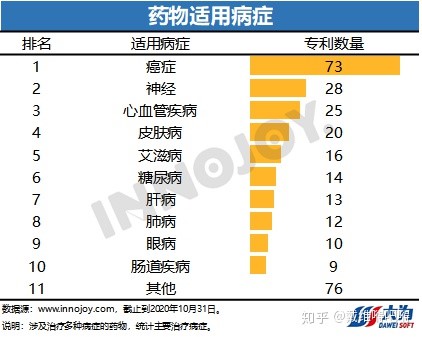
(2)延長の対象となりえる適応症(外資)
癌の適応症が73件とトップです。次いで、神経系28件、CV系25件、皮膚25件、エイズ16件となっています。
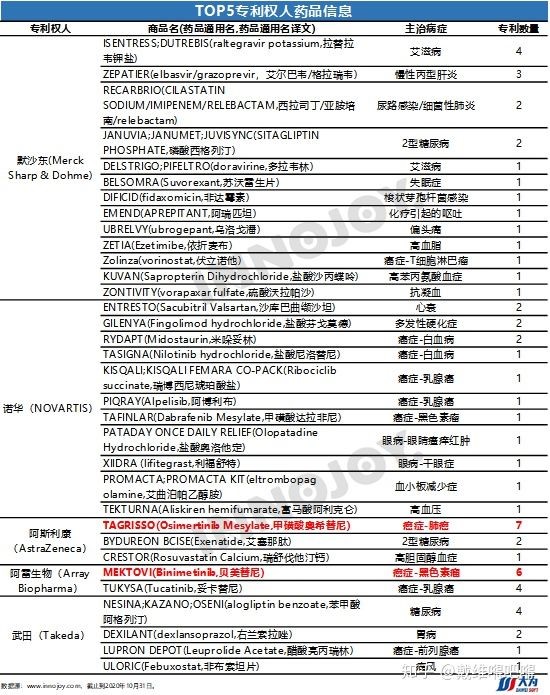
(3)特許延長申請の対象となり得る新薬(外資)
特許延長の対象となりうる新薬を一番多く有しているのはメルク社で、エイズ薬・肝炎薬等(最大13品目)、次いでノバルティスが制癌剤を中心に最大11品目を有しているとされます。なお、帝人の開発したFabuxostatは中国ではアステラスが販売していますが、下記の表は、前記のようにオレンジブック・ベースでの中国へ情報移送しているため、武田と表示されています。
上記の外資の新薬は、6月1日の時点で有効な特許が存在し、その多くは中国で既に新薬の上市承認は取得済みです。
2)内資新薬の圧力(2020年以降の中国企業によるIND・新薬承認件数に注目)
中国内資企業のIND申請数は、2018年以降急激に伸び、2020年には386件に上っています。
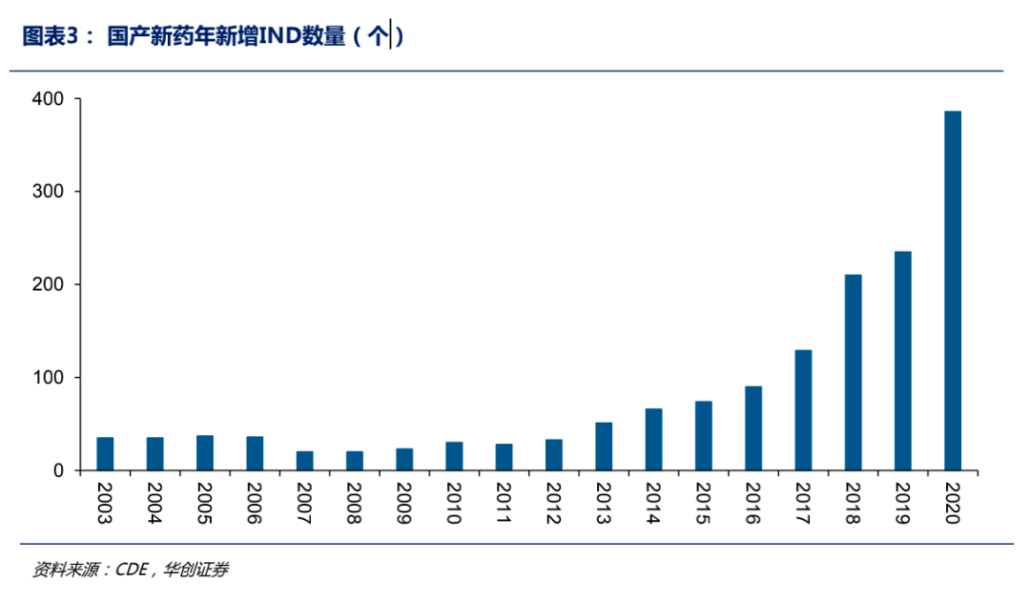
上記のIND申請数の推移から、今後中国の内資企業による新薬の上市承認の件数はさらに増加することが想定されます。直近の具体的な新薬の上市承認の取得数ですが、中国企業は2020年に11件の上市承認、2021年第一四半期(3月まで)に19件の上市承認を取得しています。このように中国国内企業の新薬の上市承認の数も無視できない数になっており、これら新薬のほとんどは、改正特許法の施行日(2021年6月)には対象の特許が有効に存続しています。
3) 2021年6月1日より以前に上市承認済みの新薬は対象外
改正特許法の施行日前に既に新薬の上市承認を取得していた外資企業、及び内資企業から、当該上市済の新薬の特許も特許期間の延長対象として欲しい(即ち、6月1日に施行される特許延長の改正法を施行日より以前の上市承認の新薬に遡及)と、政府に対して大きな圧力をかけていました。内資企業が上市承認を取得し始めたのはここ数年の出来事であって、新薬をカバーする現存特許の多くはまだ10年前後の存続期間があるのに対し、外資の新薬に関する特許は、特許満了切れが真近なものも含まれていることから、過去の承認済の新薬に遡及するか否かは、内資、外資の両方に影響があるものの、後者にとってより危急の課題となっていました。
しかしながら、前記の「暫定弁法」を特許局が発表した際の、質疑応答の席において特許局担当官は、延長申請の対象は施行日(6月1日)以降に新薬承認が下りたものに限定すると答えたことから、一応、終止符が打たれたことになっています。
今後、1か月~半年以内に特許法実施細則が最終化されることが想定されています。それを踏まえて、延長条件の詳細を説明の予定です。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年 政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表
政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表




返信を残す
Want to join the discussion?Feel free to contribute!