中国の早期上市承認プロセス5つを比較(利用度・短縮効果・実際の審査期間)
抗癌剤の開発が中国でも注目を浴びており、短いregulatory process期間内に外資の新薬のみならず内資の新薬も承認が下り、早期に市場投入されています。その背景には、政策の大転換があります。(「中国国産のPD-1免疫チェックポイント阻害剤(抗癌剤)と医療保険」、「「双通道」と医療保険(医薬品の保険適用の促進)」も参照)
中国では2015年から始まった薬事制度改革の下、承認審査関係においては、当時ジェネリック申請も含めて数千件あった上市承認の申請の滞貨に対し、滞貨圧縮の大ナタが振られました。同時に、中国にとって臨床上の必要性に緊急を要する新薬について他の申請と区別し、早期に審査承認を付与する旨の方向性が打ち出されました。2017年以降、各種の制度が公表され、それを踏まえて2020年3月に「医薬品登録管理弁法」に集大成されました。現在、下記の5つの早期上市承認プロセスが運用されています。
①「優先審査制度」(医薬品登録管理弁法§68-71)
臨床上の価値が高い薬剤(抗癌剤も含まれる)に対して、上市承認の申請の際の申し立てによって70日~130日の審査期間で承認が下りる。
②「条件付き承認制度」(同§63-67)
重篤な疾病等の治療薬で、Ph IIIの最終結果を待たずに早期臨床開発段階のデータをベースにして上市の承認申請が可能であり、上市後に実施する試験・期間等の条件を付けて承認を付与する。
③「革新治療薬プロセス」(同§59-62)
革新的な治療薬については、IND申請段階から当局との緊密な連携(プロトコール内容も含めて)が可能。
④「特別承認制度」(同§72-75)
公衆衛生上で重要な薬剤についての制度。
⑤「海外データ直接申請制度」(NMPA公告2018年79号)
重篤な疾病等の治療剤であって、米欧日で過去10年内に発売済みの特定の新薬について、人種差がないことを前提に、海外データをベースに直接、上市承認の申請を認めるとして、対象新薬がリスト化・公表されました。
次に、上記のうち3つのタイプの「早期上市承認プロセス」を利用して承認に至った、抗癌剤の新薬について、具体的に開発・審査期間がどの程度短縮されたかを見て行きます。
| 早期上市承認プロセスのタイプ | 下記表中の略号 |
|---|---|
| 「優先審査制度」 | PR |
| 「条件付き承認」 | CA |
| 「海外データ承認制度」 | UNOD |
表a:各タイプの利用の内訳
2016年~2020年の間に52種の抗癌剤の承認が下りましたが、38種が外国で開発(imported)された薬剤、14種が中国の開発(domestic)による製品です。その内44件が上述の「早期上市承認プロセス」の下での承認です。そしてimported・domestic別に、それぞれどのタイプの「早期上市承認プロセス」が利用されたかが示されています。
表b:条件付き承認の短縮効果
各タイプの「早期上市承認プロセス」の期間短縮効果によって、開発+承認審査の「全体の期間」の長さがどれくらいになったのかを示しています。「条件付き承認(+優先審査)」の対象になった10件の新薬の平均の「全体の期間」は4.3年です。これに対して「優先審査」対象のみの、国内開発による薬剤の「全体の期間」は4件の平均で11.3年でした。このように、「条件付き承認(+優先審査)」の場合は半分以上の期間短縮となっています。
表c:承認申請の審査期間
海外開発(輸入承認)の薬剤について、「条件付き承認」、「優先審査」、「早期上市承認プロセス」の適用を受けない一般の審査の期間比較を示しています。審査の期間とは、上市のための承認申請の日から最初の癌の適応症の承認が付与された日を意味します。
表d:ドラッグ・ラグ
「米国での上市の承認」から「中国での上市の承認」までの遅れの期間を3つの期間に区切って(2006-2010年、2011-2015年、2016-2020年)示しています。ドラッグ・ラグの期間は、時を追って短縮されているのが分かります。直近の5年間は、8つの新薬のドラッグ・ラグの中間値が2.7年となっています。
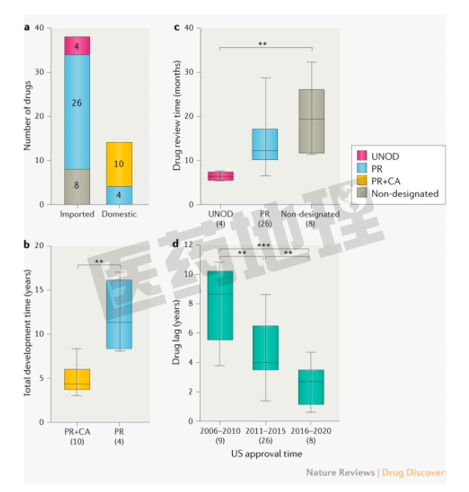
「早期上市承認プロセス」の適用を受けない一般の処理による審査期間が19.4ヵ月であるのに対し、「優先審査」では12.2ヵ月、「海外データ直接申請」では6.4ヵ月と審査期間が短縮されています。 欧米の企業は従来、欧米で上市の承認を取得してから中国での開発を開始してきたのが、過去十年で様変わりしており、欧・米・中の同時開発の時代に入って来ています。
最後に、「革新治療薬プロセス」ですが、2020年7月に開始以降27件の抗癌剤が対象として認められています。その中で、国内企業の開発は18件です。中国企業の研究開発による新薬が年を追って件数が増えており、やがてグローバル品が排出されるであろうと大きな期待が寄せられています。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 政策行政2026年2月13日中国の新薬データ保護・希少薬等の販売独占制度「医薬品管理法実施条例」公布
政策行政2026年2月13日中国の新薬データ保護・希少薬等の販売独占制度「医薬品管理法実施条例」公布 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年




返信を残す
Want to join the discussion?Feel free to contribute!