中国企業の新薬ライセンスイン(導入)一覧
今から遡ること50年、1970年代の日本の製薬産業は新薬のR&Dの本格的な勃興期、多くの企業は未だ海外からの導入品が各社の稼ぎ頭だった時代に、各社が自社研究を拡大する為に中央研究所を建設しました。それから30年経過後の21世紀に入っても中国では各社の稼ぎ頭はジェネリック品、それを巨大な工場で生産していました。その頃から新薬研究所の種蒔きが始まり、それから20年経過した今、新薬研究開発に火が着いています。
ただし、今の中国は日本の50-40年前とは火の着き方が多少違っています。日本で火の着いたころは、大手の製薬企業が欧米から上市済の新薬をライセンスイン(導入)しながら、並行して自社で自社品のR&Dを実行していくのが主流でした。これに対して中国の今は、世界の潮流が変わり、ベンチャー・キャピタルの投資マネーが駆動となって、小規模の小回りの利くバイオベンチャーが自社の研究所を立ち上げています。それと並行して、欧米から新薬のプロジェクトをライセンスIN(導入)しています。
ところが、欧米の大手は既に中国に販売部門を有していますので、昔の日本企業がそうしたように中国のベンチャーが欧米で上市済の製品を導入することは至難の業です。確かに数年前までは、中国企業は開発リスクを取る余裕がなかったので、海外承認済・上市済の新薬の導入に固執していました。しかしながら今は、早期の開発段階の新薬プロジェクトにまで食指を伸ばして、自分で開発リスクを取ってライセンスインして、中国で臨床試験等を進めています。そして、そのような中国企業に対して、欧米のベンチャーが熱心に売り込みをかけて来ています。
そういった中で、過去5年間(2015年以降)のライセンスインの数字が公表されています。それによりますと、中国の62社が導入しています。その内、導入件数のトップ5は下記の通りです。
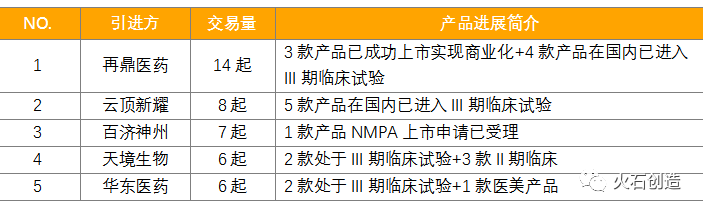
トップを切っているのは、再鼎医药(Zai Lab)です。14件の新薬プロジェクトを導入して、そのうち3製品が承認を取得して中国で上市済です。Zai Labは、2014年に上海で起業したベンチャーです。そこの名物社長のSamantha女史を始め複数のキー・メンバーは、元々中国の老舗ベンチャー和記黄埔(HutchMed)の出身です。このHutchMedは香港マネーを湯水の如く注ぎ込んで自社研究を進め、薬草成分も含めた新薬の開発を推進していました。Samantha女史は、そこのトップを辞して、米国のベンチャー・キャピタルと組んで、上海にZaiLabを立ち上げました。そして、自社研究ではなく、海外から新薬のプロジェクトを導入するビジネス・モデルで大成功しています。5~6年前はガレージ・ベンチャーだったZaiが、今は上海の浦東に大きなビルを構えており、中国の経済的な大躍進を体現している観があります。この間Zaiは、2017年に米国ナスダックで、2020年香港でIPOを果たしています。
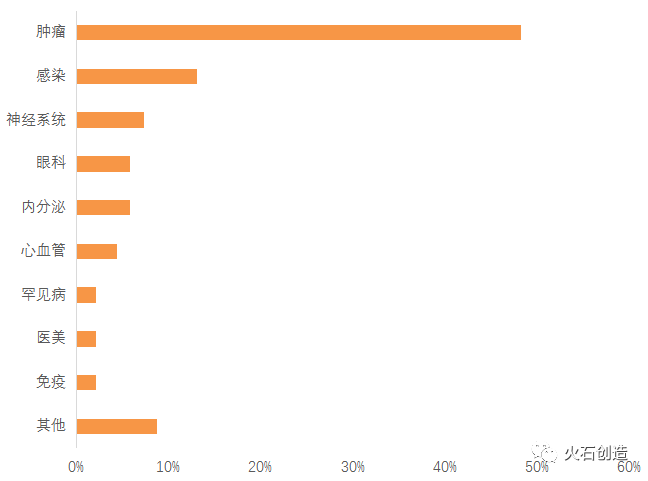
次にライセンスインされている新薬プロジェクトの適応症ですが、下記の通りで、「癌」がダントツの状況です。
件数の多さに少し驚かれるかもしれませんが、2019年から2年間のライセンスイン実績リストは下記の通りです。
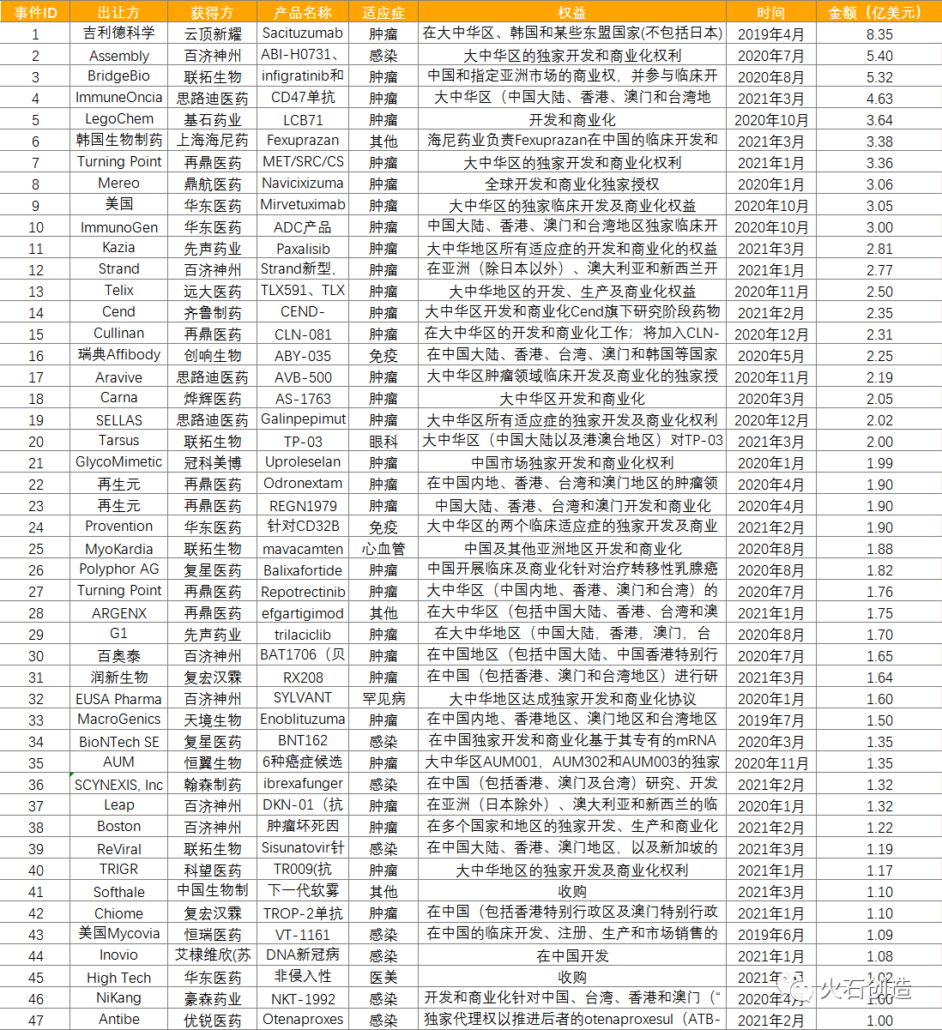
上記は中国企業がライセンスインした過去2年のリストです。5年を遡るとさらに膨大な数の新薬プロジェクトを「中国企業」が「海外のベンチャー企業等」からライセンスインしています。しかしながら、これらの新薬プロジェクトを中国側に導出した海外のライセンサーの顔ぶれを見てみますと欧米のベンチャー等がほとんどです。残念ながら、日本企業は影が非常に薄いのが現状です。日本人が何らかのマジックに掛かっているとしか言いようがないように思えます。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年 政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表
政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表




返信を残す
Want to join the discussion?Feel free to contribute!