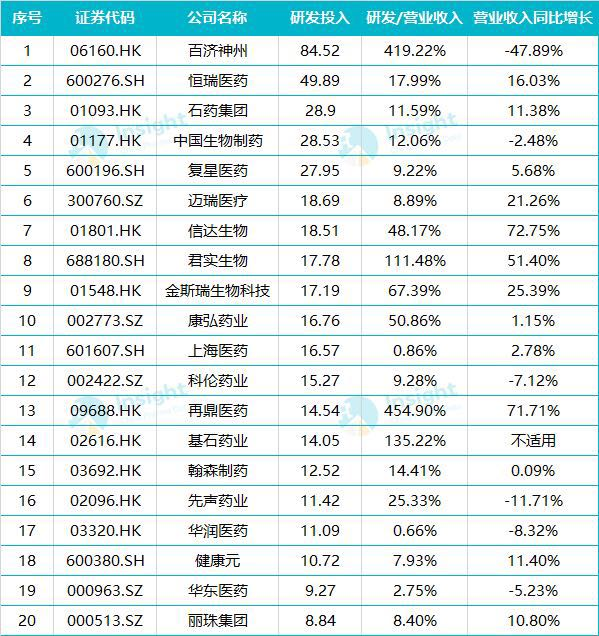
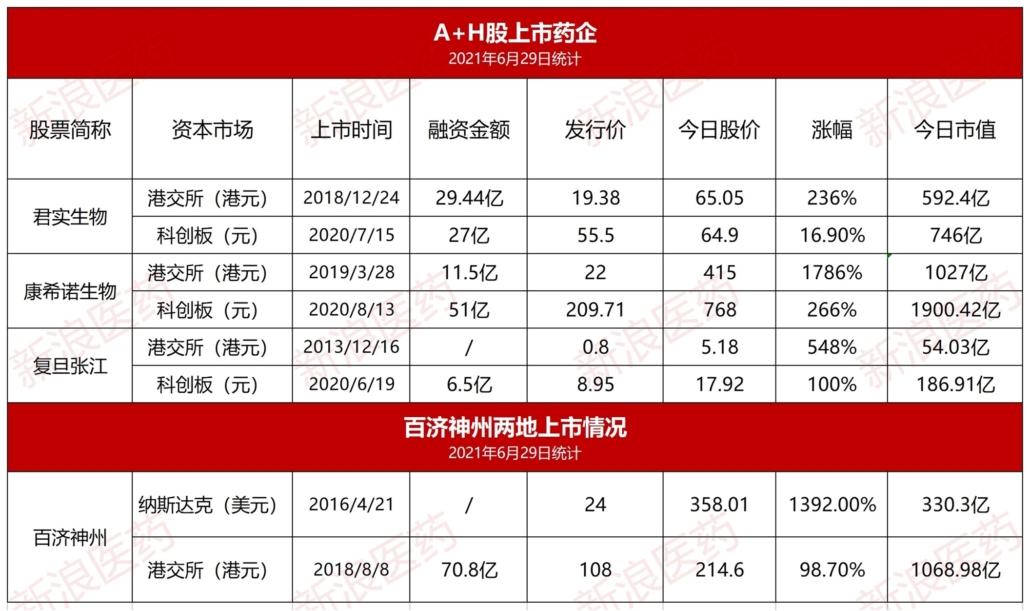
BeiGeneのPD-1抗体の承認申請とFDAの反応
BeiGene(百済神州)は2019年11月、米国FDAからBTK阻害剤(Brukinsa)を適応症:MCL(セカンドライン)として承認を取得。現在では、米・中・欧州・加・豪州を含む20か国で上市しています。そしてそれに続くグローバル品であるPD-1抗体(Tislelizumab)については、2021年1月に中国での承認が下りたのを機に、ノバルティス(Novartis)に対して米国での共同販売権を留保しつつ、中国を除くグローバルな販売権を供与(契約金アップフロント額:6億5千万ドル)。BeiGeneは、35か国で9000人の患者を組込む(うち中国:6千人、海外:3千人)臨床試験を実施してきました。
Tislelizumabの米国での最初の申請の適応症は、食道扁平上皮癌(セカンドライン)でした。中国を含むアジア、欧州、北米の10か国でなされたPhase III(512例の患者を組込み)を踏まえて、2021年9月に米国申請しました。その承認審査期限は2022年7月12日でしたが、FDAは中国でのBeiGeneの現場査察(中国)がコロナ禍の制限によって実施できなかったことを理由に、承認が見送られています。
他方、米国のライセンシーであるノバルティスによれは、肺癌(monotherapy)の米国での承認申請は見送るとしています。肺癌の臨床試験の実施場所が、中南米、中国、東欧であって、米国の人種多様性と標準治療法を十分に反映したものでない可能性があると示唆しています。
なお、中国ではすでに9つの適応症の承認を取得しており、うち5つの適応症が保険目録に収載されています。中国では一番広い適応症の承認が付与されたPD-1製品と位置づけされています。そして、欧州では複数の承認申請が受理され審査に入っています。
中国発の新薬の米国承認実績
これまで中国企業の自主開発による新薬で米国承認を得られたのは、2つの製品です。
第1号は、2019年に承認された前述のBeiGeneのBTK阻害剤(Brukinsa)です。この新薬は、まず豪州でPhase Iが実施され、その後の臨床試験は主として中国で実施されました。そして、豪州のPhase Iデータを踏まえて、中国で実施されたPivotal studyのデータのみをもって米国で承認申請されました。 但し、申請に先立って、開発の早い段階からFDAとコンタクトして、米国の規制に合致した形で中国の臨床試験が実施されていました。かかる経過を踏まえて、米国で上市承認が付与されています。
第2号は、細胞治療分野で、2022年3月にLegend社によるCAR-T(CARVYKTI)の承認です。2017年にJ&Jと提携の上、中国での臨床試験も含めた国際共同治験を進めた結果です。
中国のPhase IIIデータと米国承認
他方、今年3月、Innovent(信達生物)の自社開発にかかるPD-1について米国での承認申請が却下されました。これは、中国のpivotal studyのみに基づいて米国で申請していたのに対し、FDAより米国の標準療法を勘案の上、米国人を組み込んだ臨床試験を実施してデータを補充するようにとの指摘がされました。
中国は臨床試験大国に変貌しつつあり14億人の人口をバックに膨大な患者数をかかえていることから、患者の組込みが早く早期に臨床試験を完了させることができます。しかも、米国に比して廉価です。外資の国際共同治験の中国での実施経験を踏まえて臨床試験のデータの質も格段に進歩しています。しかしながら中国でのみPivotal studyを実施して、そのデータをもって米国でFDA承認を取得するには、対象薬剤のプロファイル(優位性、付加価値)が一番重要ですが、それに加えて米国での人種の多様性の問題をクリアの上、事前に十分FDAと臨床試験の全体像を協議・コンセンサスを得ておく必要があると、これまでの事例から示唆されています。