2025年:中国バイオ・新薬産業が潮目を変えた年
1. 中国の「自動車輸出(製品の輸出)」と「新薬ライセンス・アウト(技術の輸出)」
1-1)自動車輸出(製品の輸出)
中国からの自動車輸出台数は、過去9年間で大幅に増加しました 。2021年が「潮目」を変える年となり、前年度から輸出台数が倍増し、その後も毎年50%の比率で増加しています 。そして、昨年2024年には、ついに日本を抜いて世界最大の自動車輸出国となりました 。
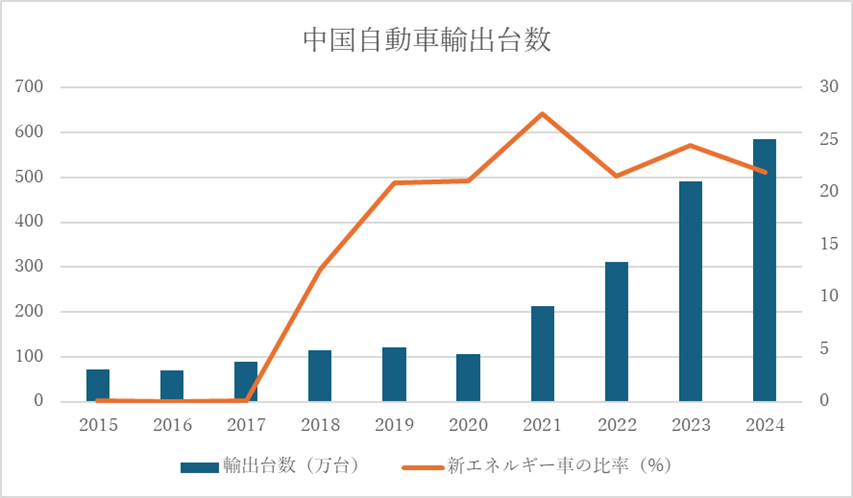
この躍進の背景には、2010年代の政府による電気自動車開発推進政策と、2020年代に入ってからの電池やモーターの技術的突破があるとされています 。
主要な輸出先はメキシコ、アラブ首長国連邦(UAE)、ロシア、ベルギー、英国—–カザフスタンなど、日本人には馴染みの少ない国々も含まれます 。筆者は上海での生活が長いため、この1〜2年で都市部において外車から国産車への切り替えが急速に進んでいるのを肌で感じています 。
1-2)新薬のライセンス・アウト(技術の輸出)と中国バイオ・新薬産業の変貌
「自動車輸出」の潮目が2021年だったとすれば、その4年後の今年2025年は、将来的に「新薬のライセンス・アウト」の潮目が変化した年と捉えられるかもしれません 。
中国政府が製薬産業の方向をジェネリックの製造・販売から新薬の研究開発主導へと転換させる政策を打ち出したのは2015年です 。この年に「44号」という政策文書が発表され、製薬産業をイノベーション主導型に変えるために、人材・インフラ・投資・知財・薬事制度などの環境を整備する構想が掲げられました 。
それから10年が経過した今年、中国企業が創出した新薬のライセンス・アウトが活況を呈しました 。過去1年間(2024年10月〜2025年8月)の、中国企業が海外企業にライセンス・アウトした実績は以下の通りです 。
<中国企業の海外への主要ライセンス・アウト/2024.10~2025.8>
| 海外企業 (ライセンス取得) | 中国企業 (新薬創出) | 対象プロジェクト 契約地域等 | 経済条件 | 契約日 |
| Sanofi | Arrowhead’s Visima | RNAi (CV) 中国・台湾の権利 | Upfront $130M Milestone $265M | 2025 8/25 |
| GSK | Hengrui | PDE3/4阻害剤等複数 | Upfront $500M Milestone $12B | 7/25 |
| AstraZeneca | CSPC | Pre-clinical | Upfront $110M Milestone $5.2B | 6/25 |
| Sandoz | Henlius | HLX13 biosimilar | Upfront $31M 総額301M | 4/25 |
| Novo Nordisk | United Labo | UBT251 Obesity/diabetes | Upfront $200M Milestone $1.8B | 3/25 |
| Roche | Innovent | DLL3 ADC | Upfront $80M Milestones $1B | 1/25 |
| GSK | Duality | ADC | Upfront $30M Milestone $975M | 2024 12/24 |
| AstraZeneca | CSPC | Oral Lpa Disruptor | Upfront $100M Milestone $1.92B | 10/24 |
| GSK | Chimagen | T cell-engager | Upfront $300M Milestone $550M | 10/24 |
新薬のライセンス・アウト(技術の輸出)先は自動車と異なり、欧米の多国籍企業が中心となっており、欧米主導で中国からの技術導入が画期的に立ち上がっています 。
また、中国企業が研究開発した新薬の中国国内での上市も続いています 。例えば、小野薬品が創出に貢献したPD-1(癌免疫)の新薬は、10社を超える中国企業が中国で製造販売しています 。第一三共が研究開発の先駆者であったADCも同様に、中国企業のADC関連プロジェクトのライセンス・アウトが続いています 。
中国の自動車産業は国内に部品などのサプライチェーンが完備していることが強みですが、新薬産業においては、データ創出サプライチェーン、すなわち「高効率・高品質・低コスト」のリソースが国内に完備している状況と言えます 。
2. 7月の政府政策文書
このような背景のもと、中国政府は2025年7月に、新薬産業のイノベーション力をさらに高め、新薬技術を重要な輸出品として育成するための政策文書《支持创新药高质量发展的若干措施》(新薬の質の高い発展を支援する諸施策)(以下「7月の政策」)を打ち出しました 。
日本の新薬研究開発は、製薬企業が製品販売で得た利益を投資に回すのが主流です 。バイオテック企業には投資資金が入るものの、新薬の臨床開発コストをカバーするには資金難に陥るのが実情でした 。
一方、中国では2016年以降、政府主導で巨額の投資資金がバイオ・新薬企業に投入されて、その時点で研究が進んでいたプロジェクトの臨床開発に対して大きな推進力を与えました。ところが。コロナ時代後半からその資金が細り始めました 。また、中国では国民の多くが利用する「基本医療保険」制度がありますが、低コストのジェネリックが前提となっているため、近年上市された自社開発の新薬が米国のような高薬価を得られず、研究費の回収が難しいという課題を抱えています。
これらの課題を解決するため、「7月の政策」では、「研究開発への資金投入」と「新薬上市後の収益回収」の両面での対策が打ち出されています 。
2-1)研究開発段階:資金面およびその他の施策
2025年は、海外へのライセンス・アウトが活況なことから、中国のバイオテック企業への投資は大幅に改善しています 。また、主要なIPO市場である香港マーケットも、中国のハイテク企業(AI、ロボット、バイオ等)の技術的躍進を背景に、海外から資金が集まり活況を呈しています 。しかし、新薬は10年単位の継続的な投資が必要であるため、長期・継続的な投資を行うための新たな枠組み作りが求められています 。
「7月の政策」では、保険会社による「創薬投資基金」が創設され、保険会社の拠出資金の10%が税額控除の対象となります 。また、医療保険データ(5億人分をカバー)のデータベース化と、企業へのアクセス権の付与も盛り込まれています 。これにより、新たな標的分子や適用症の探索が推進されることが期待されます。さらに、薬事面では審査期間のさらなる短縮が施策として掲げられています 。
2-2)発売後:利益の回収面
公的な基本医療保険が高額な新薬をカバーしきれない現状をふまえ、「7月の政策」では、富裕層(数億人)向けの商業保険で新薬をカバーする薬価リストを作成することで、企業が利益を回収できる環境を整えるとしています 。さらに、急激な薬価切り下げが起きないように、当該新薬については、政府による集中購買の対象としない方針も打ち出されています 。新薬承認後、実際に病院で採用・使用されるまでに数年かかるという問題も排除し、短期間で処方開始が進むような施策も盛り込まれています 。
まとめ
かつて日本にも、政府が産業の成長を主導した時代がありました 。中国は今でも、政策が産業動向に大きな影響を与える国です 。2015年の「44号」文書以降、新薬イノベーションを推進するための様々な政策が実施されてきました 。そして2025年、中国は一段とレベルの高い政策誘導を行い、世界の「新薬創出国・センター」へと一歩踏み出していると言えるでしょう 。
投稿者プロフィール
-
弁理士 (川本バイオビジネス弁理士事務所(日本)所長、大邦律師事務所(上海)高級顧問)
藤沢薬品(現アステラス製薬)で知財の権利化・侵害問題処理、国際ビジネス法務分野で25年間(この間、3年の米国駐在)勤務。2005年に独立し、川本バイオビジネス弁理士事務所を開設(東京)。バイオベンチャーの知財政策の立案、ビジネス交渉代理(ビジネススキームの構築、契約条件交渉、契約書等の起案を含む)を主業務。また3社の社外役員として経営にも参画。2012年より、上海大邦律師事務所の高級顧問。現在、日中間のライフサイエンス分野でのビジネスの構築・交渉代理を専門。仕事・生活のベースは中国が主体、日本には年間2-3か月滞在。
最新の投稿
 R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革
R&D新薬2025年9月29日新薬IND申請の迅速承認(30日)制度が正式に始動・中国薬事制度改革 セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催
セミナー2025年9月25日中国バイオ医薬品産業セミナー 11月5日開催 医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年
医薬市場2025年9月9日2025年:中国バイオ・新薬産業が潮目を変えた年 政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表
政策行政2025年4月24日中国の新薬「データ保護」規則(案)の公表


返信を残す
Want to join the discussion?Feel free to contribute!